
 |
|
| ABBILDUNGEN & TABELLEN | ||
Abb. 1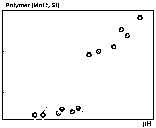 |
Abb. 2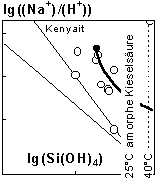 |
Abb. 3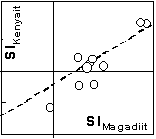 |
Tab. 1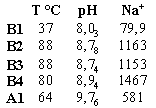 |
Tab. 2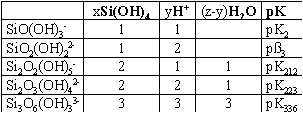 |
|
Dies führt zu einer erweiterten Vorstellung über die Bildungsbedingungen. Kieselsäure kann nicht, wie bisher anzunehmen war, in großem Umfang durch die Abkühlung alkalischer, heißer Wässer gebildet werden. Für die Bildung von amorphem SiO2 muß im wesentlichen die Abnahme des pH-Wertes angenommen werden. Die Abnahme des pH-Wertes führt aufgrund der Destabilisierung von Polymeren und der Umverteilung gelöster Monomer-Spezies zu höheren Si(OH)4-Aktivitäten. Dieses fördert die Abscheidung von amorpher Kieselsäure und begünstigt ferner die Bildung der Natriumsilikate Magadiit und Kenyait.
In der Region des Lake Magadi werden die Wässer durch vulkanische Aktivität aufgeheizt und reagieren mit vulkanischen Gesteinen, im wesentlichen Trachyte und Pyroklastika, sowie mit dem kristallinen Basement (Eugster 1970; Jones et al. 1977; Manega & Bieda 1987). Am Beispiel des Albits kommt es gemäß der Pauschalreaktion
NaAlSi3O8 + 8H2O = Al3+ + 3Si(OH)4 + 4OH- + Na+ (1)und durch hohe Evaporationsraten in den Wässern zur Anreicherung von Alkali- und Hydroxyl-Ionen sowie von Kieselsäure. Ferner nehmen die Wässer CO2 auf. Es entstammt der vulkanischen Aktivität (Hillaire-Marcel 1987). Zusätzliches CO2 kann den Wässern aus der Atmosphäre zugeführt werden. Die alkalischen Wässer dienen der Kieselsäure nach deren Mobilisation als Transportmedium. In diesen Wässern existieren gelöste polymere Kieselsäuren als stabile Komponenten im thermodynamischen Gleichgewicht. Die Analyse der spezifischen Kieselsäure-Gehalte bildet die Grundlage für die Untersuchung der Neubildung von SiO2-haltigen Festkörpern. Bisherige Arbeiten haben Polymeren eine zu geringe Bedeutung beigemessen.
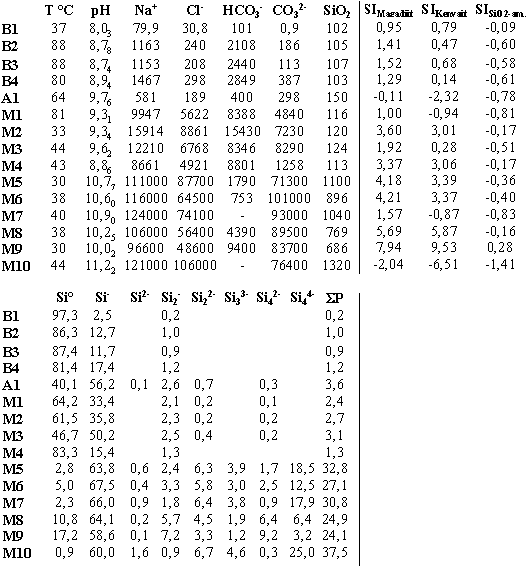 |
Tab. 1:
Chemische Zusammensetzung alkalischer Wässer in der Region des Lake Bogoria (B), des Lake Manyara (A) und des Lake Magadi (M; M5 bis M10 aus Jones et al.. 1977). Angaben in mg / l. SiO2: Gesamtkieselsäure
(mg SiO2/l). Monomer-Anteile in Mol% sind
Si°: Si(OH)4, Si-:
SiO(OH)3-, Si2-:SiO2(OH)22-Polymere-Anteile
in Mol% sind Si2-: Si2O2(OH)5-,
Si22-: Si2O3(OH)42-,
Si33-: Si3O5(OH)53-;
Si42-: Si4O6(OH)62-,Si44-:Si4O8(OH)44-;
EP = Anteil der Polymere an der gelösten Gesamtkieselsäure in
Mol% SIMagadiit, SIKenyait,
SISiO2-am.: Sättigungsindex
für Magadiit, Kenyait und amorphe Kieselsäure
|
Für die SiO2-Analytik mit der ß-Silikatmolybdat-Methode standen die Wässer B1 bis B4, A1 und M1 bis M4 mit relativ kleinen pH-Werten und geringen SiO2-Konzentrationen zur Verfügung (Tab. 1). Diese Methode beruht auf der Bildung des ß-H8Si(Mo2O7)6·28H2O-Komplexes aus Molybdat und Monomer sowie Polymer gemäß einer irreversiblen Reaktion pseudo erster Ordnung (Iler 1979; Dietzel & Usdowski 1995). In diesen Lösungen konnten polymere Kieselsäuren nachgewiesen werden. Die Gehalte sind gering und aufgrund langer Zeitspannen zwischen der Probennahme und der Messung für quantitative Aussagen nicht geeignet. In den Wässer konnten die Gehalte polymerer Kieselsäuren jedoch aus den Stabilitätskonstanten ermittelt werden.
Die gelösten polymeren Kieselsäuren entstehen nach dem Schema
ºSi-OH + HO-Siº = ºSi-O-Siº + H2O (2)durch eine Vernetzung über Silizium-Sauerstoff-Silizium-Bindungen. Die Gleichgewichte für die Polymere werden gemäß der allgemeinen Reaktionsgleichung
xSi(OH)4 = SixOz(OH)4x+y-2zy- + yH+ + (z-y)H2O (3)mit der Gleichgewichtskonstanten
(SixOz(OH)4x+y-2z y-) . (H+)y
Kxyz = ___________________________________ (4)
üblicherweise in bezug auf die monomere undissoziierte Kieselsäure angegeben. Demgegenüber existieren für die Dissoziation der monomeren Kieselsäure im wesentlichen zwei Gleichgewichte, die durch die Reaktionen(Si(OH)4) x
Si(OH)4 = SiO(OH)3- + H+ K2 (5)
Si(OH)4 = SiO2(OH)22- + 2H+ ß3 (6)gegeben sind.
Elektrolytreiche Wässer erfordern die Ermittlung der Aktivitäten gelöster Komponenten. Die Aktivitäten werden gemäß der Beziehung
ai = ãi . ci (7)aus dem Aktivitätskoeffizienten ãi und der gemessenen Konzentration ci einer Komponente i erhalten. Der Aktivitätskoeffizient für die gelöste ungeladene Kieselsäure Si(OH)4, die Bezugsgröße der Stabilitätskonstanten, wurde entsprechend der Gleichung
lgãSi(OH)4 = DHCO3 . mHCO3 + DCl . mCl + DSO4. mSO4 (8)ermittelt (Fritz et al. 1987). DHCO3, DCl und DSO4 sind temperaturabhängige Größen, und mHCO3, mCl und mSO4 bezeichnen die Molaritäten von HCO3-, Cl- und SO42-. Die D-Werte konnten näherungsweise aus den Beziehungen
DHCO3 · DCl = 0,1875 - 4,505.10-4· T + 3,05.10-7 · T2 (9)
DSO4 = 0,5437 - 2,084.10-4· T - 8,68.10-7 · T2 (10)erhalten werden. Die Aktivitätskoeffizienten der Polymere wurden mit der Davies-Gleichung
näherungsweise berechnet (e.g. Stumm & Morgan 1996). b und c sind im wesentlichen temperaturabhängige Konstanten (b = 0,5, c = 0,2 für 25°C). Die Ionenstärke(11)
ergibt sich aus den spezifischen Ionenladungen zi und den molaren Konzentrationen der gelösten Spezies ci. Die Verteilung der gelösten Kieselsäurespezies wird aus der Massenbilanz(12)
[SiO2]T = [Si(OH)4]
+ [SiO(OH)3-] + [SiO2(OH)22-]+ [Si2O2(OH)5-] + [Si2O3(OH)42-]
+ [Si3O5(OH)53-]
+ [Si4O6(OH)62-] + [Si4O8(OH)44-] (13)
erhalten. Mit den zugehörigen Konstanten für die spezifischen Kieselsäuren und deren Zahlenwerten aus Tab. 2 ergibt sich die Beziehung
[SiO2]T = [Si(OH)4]+ (10pH-9,77 gSiO(OH)3-1 + 102pH-23,1g SiO2(OH)2-1) · [Si(OH)4] gSi(OH)4
+ (102pH-19,0gSi2O2(OH)5-1 + 10pH-8,1gSi2O3(OH)4-1) · [Si(OH)4]2 gSi(OH)42
+ 103pH-27,5gSi3O5(OH)5-1. [Si(OH)4]3 gSi(OH)43
+ (102pH-13,4gSi4O6(OH)6-1 + 104pH-34,9gSi4O8(OH)4-1) · [Si(OH)4]4gSi(OH)44 (14)
In diese Funktion geht der pH-Wert und die totale SiO2- Konzentration ein. Die einzige Unbekannte ist die Si(OH)4-Konzentration. Mit dem Newton-Näherungsverfahren wurde aus der Beziehung (14) unter Berücksichtigung der Aktivitätskoeffizienten die Konzentration von Si(OH)4 bestimmt. Die spezifischen Konzentrationen der Dissoziate des Monomers und der polymeren Kieselsäuren ergeben sich aus der Si(OH)4-Aktivität und den Beziehungen (3) bis (6). In Tab. 1 sind die Anteile der Kieselsäuren zusammengestellt. In den schwach alkalischen Wässern hat das undissozierte Monomer die höchsten Konzentrationen, in den stark alkalischen Wässern die erste Dissoziationsstufe des Monomers, das SiO(OH)3-. Der Anteil der zweiten Dissoziationsstufe SiO2(OH)22- ist in allen Wässern sehr gering (< 2 %). Demgegenüber treten Dimere in Konzentrationen bis zu etwa 10 % auf (M8 und M9). Tetramere beinhalten bis zu 25 % des gelösten SiO2 (M10). Trimere sind mit Anteilen kleiner als 5 % von geringerer Bedeutung. Die Abb. 1 zeigt den Polymer-Anteil am gelösten Gesamt-SiO2-Gehalt. In der ersten Gruppe von Wässern (B1-4, A1 und M1-4) steigt der Anteil bei weitgehend konstanter SiO2-Konzentration mit dem pH-Wert kontinuierlich bis zu etwa 5 % an. In der zweiten Gruppe sind die Polymergehalte mit 25 bis 40 % deutlich größer (M5 bis 10). Dies ergibt sich durch die hohen pH-Werte und die vergleichsweise hohen SiO2-Konzentrationen in diesen Wässern.
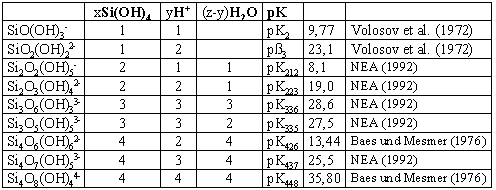 |
Tab. 2: Tableau für die Speziesverteilung gelöster Kieselsäure (25°C). x, y, z gemäß Gleichung (4) |
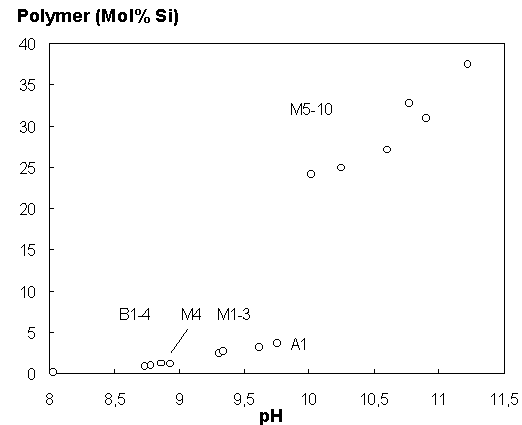 |
Abb. 1: Der Anteil von
Polymeren am totalen SiO2-Gehalt der alkalischen Wässer
(Tab. 1)
Top Menü |
NaSi7O14,5 .5,5H2O + H+ + 8H2O = Na+ + 7Si(OH)4 (15)
NaSi11O22,5 .5H2O + H+ + 16,5 H2O = Na+ + 11Si(OH)4 (16)(pKMagadiit = 14,3; pKKenyait = 25,0 - Bricker 1969; Strukturformel von Magadiit nach Lagaly et al. 1975) und für Quarz sowie für amorphe Kieselsäure die Reaktion
SiO2(s) + 2H2O = Si(OH)4 K1 (17)(pK1 (Quarz) = -3,98 - Fournier & Potter 1982; pK1 (am. Ks.) = -2,70 - Rimstidt & Barnes 1980).
Die Stabilität einer Festphase wird durch den Sättigungsindex beschrieben. Dieser wird aus der Löslichkeitskonstante und dem Ionen-Aktivitäts-Produkt gemäß der Beziehung
erhalten. Negative Werte von SI bedeuten, daß sich ein in Frage kommender Festkörper auflösen kann, SI = 0 indiziert Gleichgewicht zwischen Festkörper und Lösung, und SI > 0 bedeutet, daß eine Übersättigung vorliegt und der Festkörper abgeschieden werden kann. Neben der Na+-Aktivität und dem pH-Wert ist die Si(OH)4-Aktivität die entscheidende Größe. Während für die Ermittlung der Si(OH)4-Aktivität die Dissoziation der monomeren Kieselsäure zumeist berücksichtigt wurde (e.g. Bricker 1969; Fritz et al. 1987), sind Polymere bei der Ermittlung der Si(OH)4-Aktivitäten in keine Untersuchung einbezogen worden. Die Tab. 1 zeigt Gesamtgehalte gelöster Kieselsäuren zwischen 1,7 und 22,0 mmol SiO2 / l. Da in den kieselsäurereichen und alkalischen Wässern bis zu 40% des gelösten SiO2 an Polymere gebunden ist (Tab. 1), werden für alle Wässer sehr ähnliche und vergleichsweise geringe Si(OH)4-Aktivitäten erhalten (Mittelwert: 1,32 ± 0,56 mmol SiO2 / l). Die Abb. 2 zeigt das Verhältnis der Na+- und H+-Aktivität als Funktion der Aktivität von Si(OH)4. Die Linien stellen die Löslichkeiten von Magadiit, Kenyait und der amorphen Kieselsäure bei 25°C dar. Mit den Aktivitäten früherer Arbeiten würden die darstellenden Punkte der alkalischen und SiO2-reichen Wässer im Feld der Übersättigung an amorpher Kieselsäure liegen (lg(Si(OH)4) > 2,70). Mit den neuen Ergebnissen, unter Berücksichtigung der Polymere, ergeben sich, wie oben beschrieben, deutlich geringere Si(OH)4-Aktivitäten. Die darstellenden Punkte der Wässer liegen bis auf M9 im untersättigten Bereich für amorphe Kieselsäure (lg(Si(OH)4) < 2,70).(12)
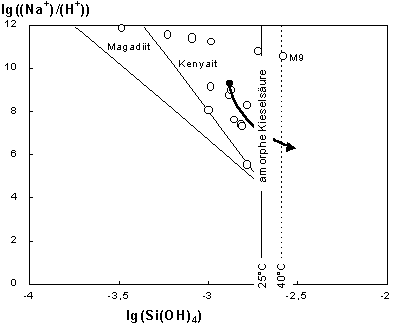 |
Abb. 2: Die darstellenden Punkte der alkalischen Wässer im Stabilitätsdiagramm von Magadiit, Kenyait und amorpher Kieselsäure bei 25°C. ( ) : Aktivitäten. Der Pfeil stellt den schematischen Verlauf bei der Abnahme des pH-Wertes in alkalischen, kieselsäurereichen Wässern dar. Der Ausgangspunkt (·) ist der Mittelwert der Aktivitäten für die untersuchten WässerTop Menü |
Die SI-Werte in Tab. 1 zeigen, daß die meisten Wässer an Magadiit und Kenyait übersättigt sind. In diesen Wässern wäre somit die Bildung dieser Natriumsilikate möglich. Die SI-Werte sind für den Magadiit systematisch größer als für den Kenyait. Die Abb. 3 zeigt, daß die SI-Werte für Kenyait und Magadiit gut korrelieren. Dies ergibt sich durch die Stöchiometrie des Reaktionsumsatzes 15 und 16 sowie der relativ konstanten Si(OH)4-Aktivität. Aus jeweils einer Beziehung 18 für den Kenyait und den Magadiit resultiert nach Umformung die Gleichung
SIKenyait = 4 lg(Si(OH)4) + lgKMagadiit - lgKKenyait + SIMagadiit (19)Mit den Zahlenwerten der Löslichkeitskonstanten gemäß der Gleichungen 15 und 16 sowie dem Mittelwert der Si(OH)4-Aktivität (1,32 mmol SiO2 / l) ergibt sich die gestrichelte Linie in Abb. 3. Die Beziehung 19 approximiert also in guter Näherung die Stabilität von Magadiit gegenüber Kenyait. Obwohl für die Wässer zum Teil hohe Übersättigungen an Magadiit und Kenyait ermittelt wurden, kann letztlich nicht entschieden werden, welches Mineral sich bildet. Wichtig ist aber, daß durch die oben beschriebene Abnahme des pH-Wertes Polymere destabilisiert werden und Si(OH)4 in geringerem Umfang dissoziert (s.a. Dietzel & Böhme 1997). Dies führt zu höheren Si(OH)4-Aktivitäten, welche die Abscheidung von amorpher Kieselsäure und die Bildung der Natriumsilikate Magadiit und Kenyait begünstigen.
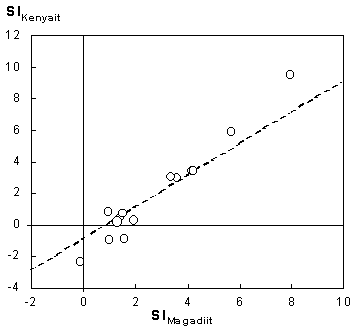 |
Abb. 3: Korrelation
zwischen den Sättigungsindizes für Magadiit und Kenyait (Tab.1)
gestrichelte Linie: SIKenyait = - 4 ·
2,88 + 10,7 + SIMagadiit
|
BRICKER, O. P. (1969): Stability constants and free energies of formation of Magadiite and Kenyaite.- Amer. Mineral. 5, 1026-1033
DIETZEL, M.., USDOWSKI, E. (1995): Depolymerization of soluble silicate in dilute aqueous solutions.- Colloid Polym. Sci. 273, 590-597
DIETZEL, M., BÖHME, G. (1997): Adsorption und Stabilität von polymerer Kieselsäure.- Chem. Erde 57, 189-203
EUGSTER, H. P. (1970): Chemistry and origin of the brines of Lake Magadi, Kenya.- Miner. Soc. Amer. Spec. Paper 3, 213-235
FOURNIER, R. O., POTTER, R. W. (1982): An equation correlating the solubility of quartz in water from 25°C to 900°C at pressures up to 10.000 bars.- Geochim. Cosmochim. Acta 46(10), 1969-1974
FRITZ, B., ZINS-PAWLAS, M.-P., GUEDDARI, M. (1987): Geochemistry of silica-rich brines from Lake Natron (Tanzania).- Sci. Geol. Bull. 40, 97-110
HILLAIRE-MARCEL, C. (1987): Hydrologie isotopic des Lacs Magadi (Kenya) et Natron (Tanzanie).- Sci. Geol. Bull. 40, 111-120
ILER, R. K. (1979): The chemistry of silica - Solubility, Polymerization, Colloid and Surface Properties, and Biochemistry.- Wiley- Interscience, New York, 866p
JONES, B. F., EUGSTER, H. P., RETTIG, S. F. (1977): Hydrochemistry of the Lake Magadi basin, Kenya.- Geochim. Cosmochim. Acta 41(1), 53-72
LAGALY, G., BENECKE, K., WEISS, A. (1975): Magadiit and H-Magdiit. I-Sodium Magadiit and some of its derivatives.- Amer. Mineral, 60, 642-649
MANEGA, P., BIEDA, S. (1987): Modern Sediments of Lake Natron, Tanzania.- Sci. Géol. Bull. 40, 83-95 NEA. (1992): Chemical Thermodynamics of Uranium. Nuclear Energy Agency.- Elsevier, Netherland, 721p
RIMSTIDT, J. D., BARNES, H. L. (1980): The kinetics of silica-water reactions.- Geochim. Cosmochim. Acta 44(11), 1683-1699
STUMM, W., MORGAN, J. J. (1996): Aquatic chemistry - Chemical equilibria and rates in natural waters.- 3nd ed. Wiley-Intersience New York, 1022p
VOLOSOV, A. G., KHODAKOVSKIY, I. L., RYZHENKO, B. N. (1972): Equilibria in the system SiO2 – H2O at elevated temperatures along the lower three-phase curve.- Geochem. Internat. 9, 362-377