 |
JAHRESTAGUNG
DER DTTG 1998 3. - 5. September 1998,
Greifswald Berichte der DTTG e.V. - Band
6
|
Randbedingungen für die elektrochemische Bodensanierung
S. Preiss & W.
Czegka
GeoForschungsZentrum Potsdam, Telegrafenberg, 14473 Potsdam
| ABBILDUNGEN |
Abb. 1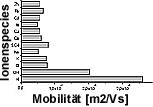 |
Abb. 2![Abb. 2. Spezifische Oberflächenleitfähigkeit als Funktion der Fluidleitfähigkeit [NaCl]](Prei02s.jpg) |
Abb. 3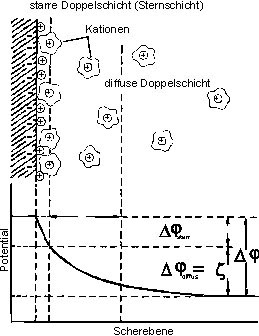 |
Abb. 4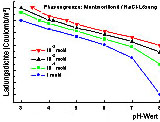 |
Abb. 5 |
Abb. 6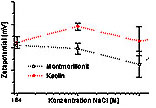 |
Abb. 7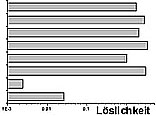 |
Abb. 8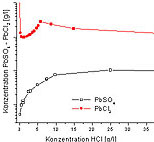 |
Einleitung
Elektrochemische Methoden der Bodensanierung finden heute zunehmend größeres
Interesse. Diese Verfahren sind auch in feinkörnigen, tonmineralhaltigen
Böden anwendbar, die bei der konventionellen Bodenwäsche schwer
sanierbar sind. Eine Anwendung der elektrochemischen Verfahren insitu ist
denkbar. Im vorliegenden Beitrag sollen die Randbedingungen dieser Sanierungsmethode
aus den elektrokinetischen Daten am Beispiel der Tonminerale Montmorillonit
und Kaolin hergeleitet werden. Die elektrochemische Bodensanierung beruht
auf der Migration von Ionen im elektrischen Feld. Dadurch können u.a.
Schwermetalle aus Böden entfernt werden. Ferner führt das elektrische
Feld zu einem Fluidtransport der als Elektroosmose bezeichnet wird. Dieser
elektroosmotische Transport ist zum Austrag organischer Schadstoffe (Phenol,
Benzol, etc.) nutzbar.
Top
Menü
Ionenmigration
Voraussetzung für die elektrochemische Bodensanierung ist, daß
die zu entfernenden Schwermetalle als gelöste Ionen vorliegen. Dies
kann durch dosierten Säurezusatz erreicht werden. Für das Entfernen
der Schwermetalle ist daher die Ionenmobilität der entscheidende Parameter.
In Abb. 1 sind die Mobilitäten verschiedener
Ionenspezies dargestellt. Es ist ersichtlich, daß die Schwermetalle
deutlich geringere Mobilitäten als H+- bzw. OH--Ionen
besitzen. Der Stromverbrauch wird somit wesentlich von der Konzentration
der H+/OH-- Ionen bestimmt. Aus diesem Grund sollte
der pH-Wert nicht zu stark sauer werden. Um die Leitfähigkeit gering
zu halten muß ein elektrolytarmes Wasser verwendet werden. Bei zu
hohen Konzentrationen wird der Strom für den Transport der Elektrolyt-Ionen
und nicht der Schwermetalle verbraucht.
Top
Menü
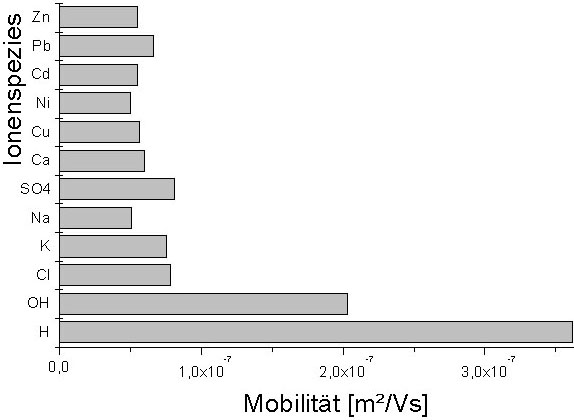 |
Abb. 1: Ionenmobilität
nach Jander et al. 1986
|
Oberflächenleitfähigkeit
Die elektrische Leitfähigkeit im Boden hängt neben der Fluidleitfähigkeit
auch von der inneren Oberfläche und der spezifischen Oberflächenleitfähigkeit
ab. Der Anteil der Oberflächenleitfähigkeit an der Gesamtleitfähigkeit
nimmt in verdünnten Lösungen zu. Schließlich wird die Oberflächenleitfähigkeit
zum bestimmenden Leitfähigkeitsprozess. Dies liegt daran, daß
die Fluidleitfähigkeit mit der Konzentration sehr viel stärker
als die Oberflächenleitfähigkeit abnimmt. Experimentelle Daten
(siehe Abb. 2) zeigen eine Abnahme der spezifischen
Oberflächenleitfähigkeit mit der abnehmenden Fluidleitfähigkeit
für die Tonminerale Montmorillonit und Kaolin sowie für Quarz.
Da die Ausdehnung der diffusen Doppelschicht in verdünnten Lösungen
zunimmt, muß der Mechanismus der Oberflächenleitfähigkeit
innerhalb der starren Doppelschicht wirken (siehe Abb.
3). Die Ladungsdichte der Mineraloberfläche steigt mit der NaCl-
Konzentration (siehe Abb. 4), dies erklärt die
höhere Oberflächenleitfähigkeit. Die höchste Ladungsdichte
und damit der Maximalwert der Oberflächenleitfähig-keit ist von
der Flächendichte der austauschbaren Kationen und damit vom jeweiligen
Mineral abhängig. Auch im Hinblick auf die Oberflächenleitfähigkeit
ist somit eine niedrige Fluidkonzentration günstig.
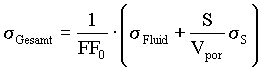
(1)
sGesamt, sFluid
: Elektrische Leitfähigkeit [S/m];
sS: Oberflächenleitfähigkeit
[S]
FF0: Formationswiderstandsfaktor;
Vpor : Porenvolumen [m³]
S: Oberfläche [m²]
Top
Menü
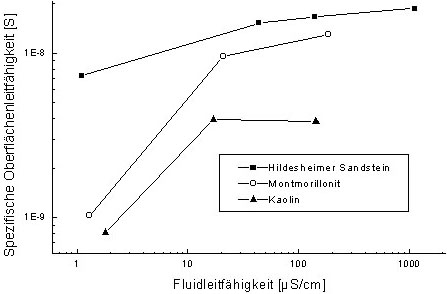 |
Abb. 2: Spezifische
Oberflächenleitfähigkeit als Funktion der Fluidleitfähigkeit
[NaCl]
|
 |
Abb. 3: Aufbau der Phasengrenzfläche
Mineral-Elektrolyt nach dem Stern-Modell (1924)
|
 |
Abb. 4: Oberflächenladungsdichte
von Montmorillonit in NaCl.
|
Elektroosmose
Sollen unpolare organische Schadstoffe mit elektrochemischen Methoden aus
dem Boden entfernt werden (z.B. Phenol), kommt nur der elektroosmotische
Volumenstrom als Prozess in Frage. Die Möglichkeit dieses Prozesses
wurde von Acar et al. (1992) im Labormaßstab gezeigt. Die
Elektroosmose wird durch die Helmholtz-Smoluchowski-Gleichung beschrieben:
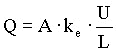
(2)
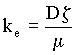 (3)
(3)
Q: Volumenstrom [m³/s]
A: Fläche [m²]
ke: Elektroosmotischer Durchlässigkeitsbeiwert
[m²/Vs] U: Spannung
[V]
D: Dielektrizitätszahl [C/Vm]
L: Probenlänge [m]
z: Zetapotential [V]
µ: Viskosität [Pa·s]
Um den Volumenstrom bei gegebener Feldstärke zu maximieren sollte
ein möglichst hohes Zetapotential (elektrisches Potential an der Scherebene
vgl. Abb. 3) angestrebt werden. Abb.
5 zeigt die Abhängigkeit des Zetapotentials vom pH- Wert. Die
Konzentrationsabhängigkeit ist in Abb. 6 dargestellt.
Für die Elektroosmose sind verdünnte alkalische Lösungen
günstig, da diese einen hohen Volumenstrom bei geringem Energieeinsatz
ermöglichen. Wie in Abb. 4 gezeigt ist die Oberflächenladungsdichte
bei Montmorillonit in sauren Lösungen positiv, dies führt auch
zu einem positiven Zetapotential (Abb. 5). Dadurch
erfolgt der elektroosmotische Transport zur Anode. Dies steht im Gegensatz
zum üblicherweise beobachteten Transport zur Kathode. Der pH- Wert
an dem das Zetapotential Null ist, wird als pHpzc (point of zero charge)
bezeichnet (s. Abb. 5). In diesem Fall findet kein
elektroosmotischer Transport statt. Die Elektroosmose in Richtung Kathode
verstärkt das Vordringen der Säurefront. Im Fall des positiven
Zetapotentials wird das Vordringen der Säurefront verlangsamt. Die
Schwermetallanreicherung findet in diesem Fall räumlich von der Kathode
entfernt statt.
Top
Menü
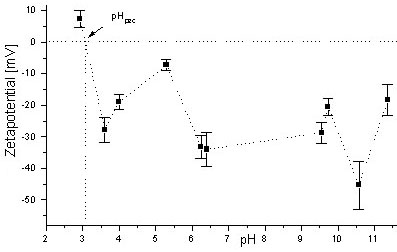 |
Abb. 5: pH-Wert Abhängigkeit
des Zetapotentials von Montmorillonit (Mikroelektrophorese)
|
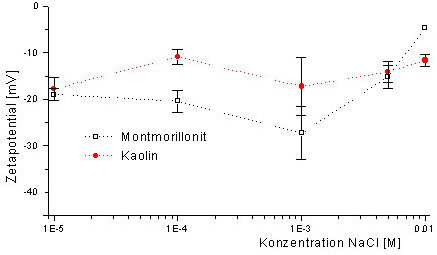 |
Abb. 6: Konzentrationsabhängigkeit
des Zetapotentials (Mikroelektrophorese)
|
Löslichkeit
Die Wahl der Spülflüssigkeit sollte von der Löslichkeit
der Schwermetalle abhängig gemacht werden. Die Abb.
7 zeigt deutlich, daß Salzsäure aufgrund der allgemein höheren
Löslichkeiten der Chloride als Spülflüssigkeit zu bevorzugen
ist. Zu Beachten ist die Bildung von Chlorokomplexen bei hohen HCl-Zusätzen.
Am Beispiel der in Abb. 8 gezeigten Löslichkeiten
ist der Einfluß der Bleichlorokomplexe zu sehen. Diese migrieren
im Gegensatz zu den Pb2+- Ionen in den Anodenraum.
Top
Menü
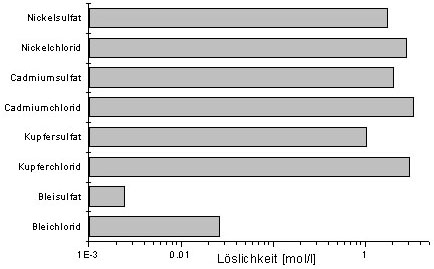 |
Abb. 7: Löslichkeiten
verschiedener Schwermetallchloride und -sulfate
|
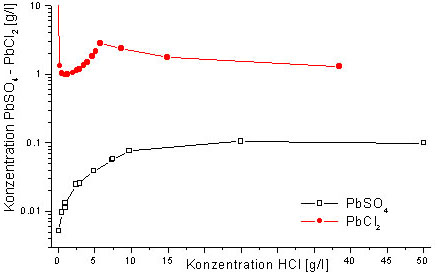 |
Abb. 8: Löslichkeit
von PbCl2 und PbSO4 in HCl nach Gmelin
1969
|
Folgerungen
Die Möglichkeit der elektrochemischen Bodensanierung wurde bereits
von mehreren Autoren im Labormaßstab angewandt (detaillierte Literaturhinweise
in Hiesel 1996). Entscheidend für die Kosten einer elektrochemischen
Bodensanierung ist der Stromverbrauch pro ausgetragener Menge Schadstoff.
Dieser ist bedingt durch die elektrische Leitfähigkeit des Fluids
(pH-Wert, Konzentration, Ionenmobilität) und die Oberflächenleitfähigkeit
der Minerale. Als prinzipiell neuer Ansatz für die Anwendbarkeit des
Verfahrens in der Bodensanierung wird hier die Optimierung der Prozeßparameter
(Fluidleitfähigkeit, Oberflächenleitfähigkeit, Zetapotential)
in Abhängigkeit vom Mineralgehalt vorgestellt. Es können folgende
Schlußfolgerungen abgeleitet werden:
-
Die Mobilisierung der Schwermetalle muß durch einen Säurezusatz
sichergestellt werden. Die größten Schwierigkeiten sind hier
beim Blei mit den geringsten Löslichkeiten zu erwarten.
-
Der Säurezusatz darf nicht zu hoch gewählt werden (pH > pHpzc)
um den elektroosmotischen Wassertransport als unterstützende Maßnahme
zu gewährleisten und den Stromverbrauch zu begrenzen.
-
Unpolare Schadstoffe sollen dagegen im alkalischen Bereich saniert werden,
um den elektroosmotischen Volumenstrom zu optimieren.
Die Überführung der optimierten elektrochemischen Bodensanierung
in den Technikumsbereich steht noch aus.
Top
Menü
Literatur
ACAR, Y. B., LI, H., GALE, R. Y. (1992): Phenol removal from kaolinite
by electro-kinetics.- J.Geotech.Eng., 118 (11), 1837-1852.
Autorenkollektiv (1969): Gmelins Handbuch der anorganischen Chemie Blei
47, Teil C Lieferung 1, S. 47.
HIESEL, E. (1996): Elektrokinetische Bodensanierung. Einsatzmöglichkeiten
in KW-kontaminierten Feinklastika.- Unveröff. Dipl.-Arbeit, TU Karlsruhe,
109 S.
JANDER, G., JAHR, K. F., SCHULZE, G. (1986): Maßanalyse: Theorie
und Praxis der Titrationen mit chemischen und physikalischen Indikatoren.-
Berlin, New York, de Gruyter, S. 233.
STERN, O. (1924): Zur Theorie der elektrolytischen Doppelschicht.- Z.
Elektrochem., 30, 508-516.
Top
Menü



![Abb. 2. Spezifische Oberflächenleitfähigkeit als Funktion der Fluidleitfähigkeit [NaCl]](Prei02s.jpg)







(1)



(2)
(3)



