 |
|
| GLIEDERUNG | |
| Zusammenfassung | Ergebnisse und Diskussion |
| Einleitung | Schlußbetrachtung |
| Material & Methoden | Literatur |
| ABBILDUNGEN | ||
Abb. 1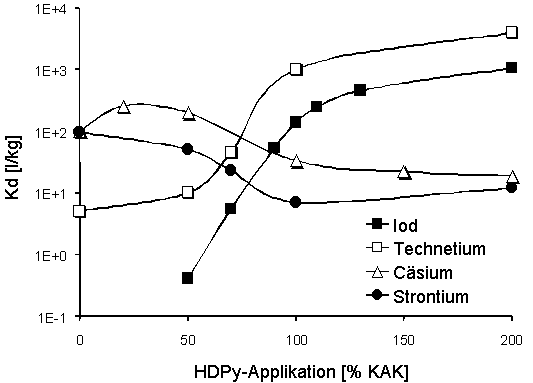 |
Abb. 2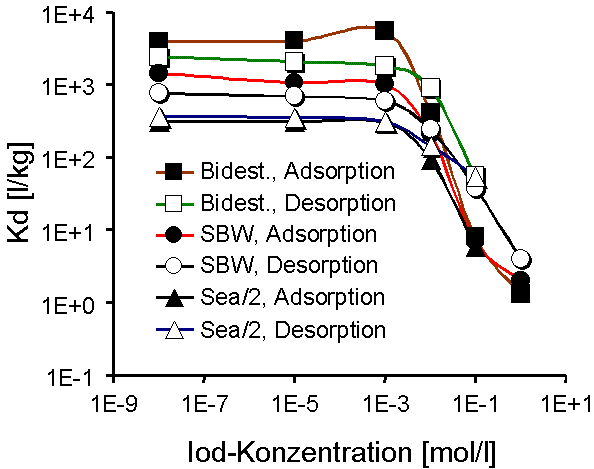 |
Abb. 3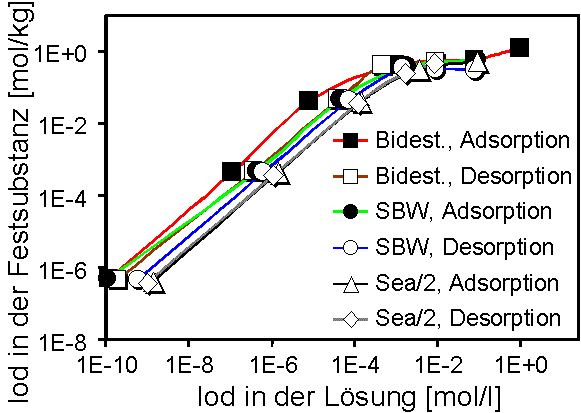 |
Abb. 4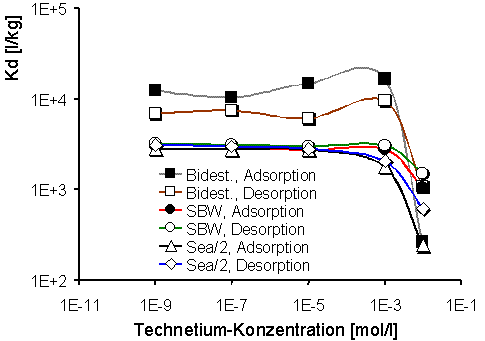 |
Abb. 5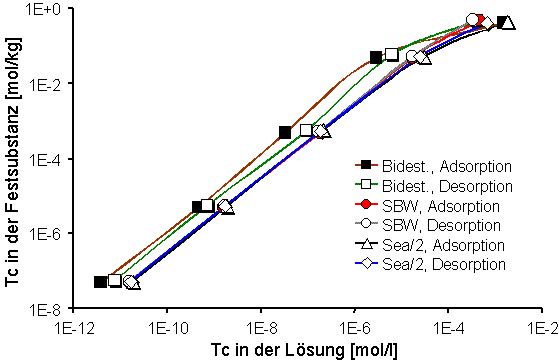 |
|
Die Anionenadsorption setzt bei einer HDPy-Applizierung von 70 % der KAK ein und erreicht das Maximum, wenn HDPy+ in Konzentrationen von 200 % der KAK angeboten wird (Aufnahme ~150 % der KAK). Die Verteilungskoeffizienten für die beiden Anionen bleiben bis zu einer Anfangskonzentration von ~5·10 -3 mol ·l-1 konstant, und die Isothermen verlaufen in der log-log Darstellung bis zu einer Ionenkonzentration in der Festsubstanz von ~1·10-1 mol·kg-1 linear. Dies deutet auf Ionenaustausch als den dominierenden Adsorptionsmechanismus hin. Die Adsorption von Iodid wird erheblich, die des Pertechnetats dagegen nur unwesentlich von der chemischen Zusammensetzung (Ionenstärke) der Gleichgewichtslösungen beeinflußt. In nur partiell mit HDPy+ belegten MX-80 Proben wird eine Adsorption sowohl von Anionen (I-, TcO4-) als auch von Kationen (Cs+, Sr2+) beobachtet.
Eingehende Untersuchungen haben gezeigt, daß Tonminerale durch
Austausch der anorganischen Zwischenschichtkationen gegen organische Kationen
(z.B. quartäre Alkylammoniumionen) so modifiziert werden können,
daß sie große Mengen von nichtionischen organischen Verbindungen,
wie z. B. chlorierte Phenole (Mortland et al. 1986; Stockmeyer 1991) sowie
auch Radioiodid binden können (Bors 1990; Bors et al.
1994). Mit steigendem Gehalt an organischen Kationen steigt die Iodidaufnahme,
während die Adsorption von Cäsium und Strontium dabei kontinuierlich
abnimmt (Bors et al. 1997, 1998).
Im Hinblick auf die Eignung von modifizierten Bentoniten als
technische Barrieren in Endlagern werden in der vorliegenden Arbeit Sorptions-
und Desorptionsexperimente (Batch-Verfahren) mit 125I und 95mTc
und den entsprechenden Trägersubstanzen mit Wyoming-Bentonit MX-80,
belegt mit Hexadecylpyridinium (HDPy+) in Konzentrationen des 0,2- bis
2,0-fachen der Kationenaustauschkapazität (KAK), beschrieben. Besonderes
Augenmerk wird dabei auf den Einfluß der Gleichgewichtslösungen
unterschiedlicher Ionenstärke gerichtet.
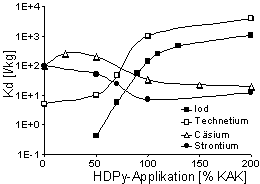 |
Abb. 1: Adsorption (Kd-Werte) von Iod, Technetium, Cäsium und Strontium an unterschiedlich mit HDPy+ belegtem MX-80-Bentonit (Synthetisches Bodenwasser; Trägerkonzentration jeweils 1·10-5 mol· l-1). |
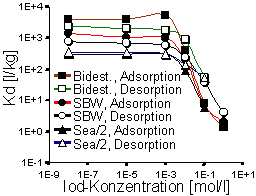 |
Abb. 2: Verteilungskoeffizienten (Kd) für Iodid in organophilem MX-80-Bentonit (HDPy+: 200 % der KAK) als Funktion der Anfangskonzentration des KI-Trägers. |
Die Adsorptionsversuche erfolgten mit Hilfe der Batch-Technik bei 22°C und Schüttelinkubation von 0,2 g Probenmaterial in 10 ml bidestilliertem Wasser, synthethischem Bodenwasser (SBW) und "Seewasser" mit halber Ionenstärke (Sea/2). Die Zusammensetzung der beiden Lösungen ist in Tab. 1 angegeben.
Als Träger wurden KI bzw. Na ReO4 für Technetium, von dem kein stabiles Isotop existiert, in Konzentrationen von 10-8-10-1 mol· l-1 verwendet. In Untersuchungen ist belegt worden, daß ReO4- und TcO4- in Größe, Struktur und Adsorptionsverhalten vergleichbar sind (Kang et al. 1998). Nach Erreichen des Gleichgewichtszustandes wurden die feste und die flüssigen Phasen durch Zentrifugieren (20 000 g, 20 min) getrennt und aus der Aktivität der Lösung vor und nach der Inkubation Verteilungskoeffizienten (Kd-Werte) ermittelt. Kd ist dabei definiert als das Verhältnis der Konzentrationen in der festen und in der flüssigen Phase. Unter Einbeziehung der Kd-Werte und der Konzentration der Ionen in den Gleichgewichtslösungen wurden die adsorbierten Mengen der Substanzen errechnet. Zur Charakterisierung der Desorption wurden die aktiven Mineralproben nach Zentrifugieren und Dekantieren (Sorption) wieder in 10 ml der Gleichgewichtslösungen ohne den radioaktiven Tracer dispergiert, inkubiert und erneut Kd-Werte ermittelt. Die Versuche wurden mit drei Wiederholungen durchgeführt.
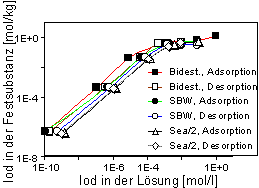 |
Abb. 3: Adsorptions- und Desorptionsisothermen von Iodid in HDPy-Bentonit mit bidestilliertem Wasser, synthetischem Bodenwasser (SBW) und Sea/2-Wasser. |
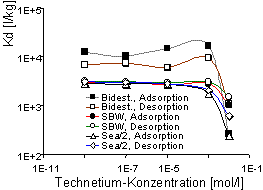 |
Abb. 4: Verteilungskoeffizienten (Kd) für Pertechnetat in organophilen MX-80-Bentonit (HDPy+: 200 % der KAK) als Funktion der Anfangskonzentration des Trägers |
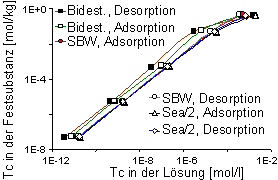 |
Abb. 5: Adsorptions- und Desorptionsisothermen von Pertechnetat in HDPy-Bentonit mit bidestilliertem Wasser, synthetischem Bodenwasser (SBW) und Sea/2-Wasser. |
Im weiteren wird das Adsorptions- und Desorptionsverhalten der anionischen Radionuklide am Beispiel des HDPy-200-Bentonit dargestellt. Abb. 2 zeigt die Verteilungskoeffizienten, Kd, für Iodid als Funktion der Anfangskonzentration des Trägers KI in bidestilliertem Wasser, SGW und Sea/2-Wasser. Aus dem Verlauf der Kurven ist ersichtlich, daß die Verteilungskoeffizienten von der Trägersubstanz bis zu einer Anfangskonzentration des zugegebenen KI-Trägers von 1·10-3 mol·l-1 weder in der Adsorption noch in der Desorption nennenswert beeinflußt werden. Bei höheren Iodidkonzentrationen ist eine stetige Abnahme der Kd-Werte zu erkennen. Die Größe der Verteilungskoeffizienten zeigt eine deutliche Abhängigkeit von der Ionenstärke der verwendeten Gleichgewichtslösungen. Dies deutet auf mögliche Konkurrenzreaktionen der gelösten Ionen hin. Es ist auch möglich, daß ein Anteil der Alkylammoniumionen, zumal bei einer Aufnahme oberhalb der KAK, weniger intensiv gebunden ist und möglicherweise durch Kationen der Gleichgewichtslösung wieder ausgetauscht werden kann. Diesem Aspekt wird in zur Zeit laufenden Versuchen nachgegangen. In bidestilliertem Wasser und SBW liegen die Werte der Desorption deutlich unterhalb derer der Adsorption, was darauf hindeutet, daß ein Teil der sorbierten Iodidionen wieder in die Lösung abgegeben wird. Dieser Effekt wurde in Sea/2-Lösung nicht beobachtet: Hier verlaufen die Kurven für Adsorption und Desorption auf annähernd gleicher Höhe, was auf Reversibilität der Vorgänge schließen läßt.
Aus den Verteilungskoeffizienten und den Sorbatkonzentrationen wurden Adsorptions- und Desorptionsisothermen (Konzentration des Sorbats in der Festsubstanz gegen Konzentration in der Gleichgewichtslösung) berechnet. Abb. 3 zeigt Isothermen für Iodid.
An Hand der log-log Darstellung der Isothermen lassen sich mindestens zwei, durch verschiedene Steigungen charakterisierte Bereiche unterscheiden. Bis zu einer Sorbatkonzentration von ca. 5·10-3 mol·l-1 bzw. 5·10-1 mol·kg-1 verlaufen die Isothermen linear (Ausnahme: Bidest, Adsorption) und haben eine Steigung von 1 (Freundlich-Isotherme). Dies deutet auf Ionenaustausch als den dominierenden Adsorptionsmechanismus hin. Für höhere Konzentrationen wird eine starke Abweichung von der Linearität festgestellt. Es gibt Hinweise, daß ein Teil der Alkylammoniumionen als Moleküle aufgenommen werden, und die Gegenionen von HDPy+ stünden somit für einen Anionenaustausch zur Verfügung (Holz & Sörensen 1992; Lagaly 1995). Vom Gesamtverlauf der Isothermen läßt sich zumindest auch ein zweiter Adsorptionsmechanismus für Iodidionen vermuten. Das Adsorptionsverhalten von Technetium (Pertechnetat) als einem weiteren anionischen Spaltprodukt mit Endlager-Relevanz ist in Abb. 4 dargestellt. Danach liegen die Kurven der Kd-Werte generell höher (höchste Werte um 10 000 l·kg-1) als beim Iodid und bleiben auf gleicher Höhe bis ca. 1·10-3 mol·l-1 der Anfangskonzentration des Pertechnetats.
Die Adsorptions- und Desorptionskurven für die Lösungen SBW und Sea/2-Wasser liegen im Vergleich zum bidestilliertem Wasser etwas niedriger (ca. 3000 l·kg-1). Ansonsten hat die Ionenstärke der Gleichgewichtslösungen keinen wesentlichen Einfluß auf die Adsorption und Desorption von Technetium. Die Adsorptions- und Desorptionsisothermen für Pertechnetat sind bis zu einer Sorbatkonzentration von ~1·10-5 mol·l-1 bzw. ~1·10-1 mol·kg-1 linear (Abb. 5). Auch bei höheren Konzentrationen weichen sie weniger stark von der Linearität ab als dies beim Iodid der Fall ist. Reversible Reaktionen sind mit SBW und Sea/2-Wasser zu beobachten, während die Adsorption mit bidestilliertem Wasser nur partiell reversibel ist.
Die Arbeiten werden im Rahmen des `Nuclear Fission Safety`-Programmes der Europäischen Kommission (1994-1998) unter Kontrakt F14WCT950012 durchgeführt.
BORS, J. (1990): Sorption of radioiodine in organo-clays and soils.- Radiochim. Acta 51, 139-143.
BORS, J., GORNY, A., DULTZ, S. (1994): Some factors affecting the interactions of organophilic clay minerals with radioiodine.- Radiochim. Acta, 66/67, 309-313.
BORS, J., GORNY, A., DULTZ, S. (1997): Adsorption of radionuclides on organophilic bentonite.- Can. J. Soil Sci., accepted.
BORS, J., DULTZ, S., RIEBE, B. (1998): Sorption of Iodide, Cesium and Strontium on Organophilic Bentonite.- Radiochim. Acta, accepted.
DULTZ, S., BORS, J. (1998): Untersuchungen an HDPy-Montmorillonit hinsichtlich des Einsatzes als Anionen-und Kationenadsorber in der Geotechnik.- Berichte der DTTG e. V., Jahrestagung Greifswald, 3.-5. September 1998, 88-97.
HOLZ, M., SÖRENSEN, M. (1992): Direct detection of an attractive interaction between anions and hydrophobically hydrated unpolar groups.- Ber. Bunsenges. Phys. Chem. 96, 1441-1447.
KANG, M. J., CHUN, K. S., RHEE, S. W., MOON, H., FANGHÄNEL, T., NECK, V. (1998): Sorption of MO4- (M=Tc, Re) on Mg/Al Layered Double Hydroxide and Characterization of Reconstructed LDH with ReO4-.- Radiochim. Acta, in press.
LAGALY G. (1995): Surface and interlayer reactions: Bentonites as adsorbents.- In: G. J. CHURCHMAN, R. W. FITZPATRICK, R. A. EGGLETON (Editors): Clays: Controlling the environment.- Proc. 10th Int. Clay Conference, CSIRO Bookshop, East Melbourne, 137-144.
LIESER, K. H., BAUSCHER, C. (1987): Technetium in the hydrosphere and in the geosphere.- Radiochim. Acta, 42, 205-213.
LIESER, K. H., STEINKOPFF, T. H. (1989): Chemistry of radioactive iodine in the hydrosphere and in the geosphere.- Radiochim. Acta 46, 49-55.
MADSEN, F. T. (1998): Clay mineralogical investigations related to nuclear waste disposal.- Clay Miner., 33, 109-129.
MCCOMBIE,C., MCKINLAY, I. G., LAMBERT, A., THURY, M., BIRKHÄUSER, P. (1995): The swiss strategy for HLW siting; parallel investigation of two alternative host rocks.- Scientific Basis for Nuclear Waste Management, 18: 1363-1370.
MORTLAND, M. M., SHAOBAI, S., BOYD, S. A. (1986): Clay-organic complexes as adsorbents for phenol and chlorophenols.- Clays Clay Miner., 34, 581-585.
MÜLLER-VONMOOS, M., KAHR, G. (1983): Mineralogische Untersuchungen von Wyoming-Bentonit MX-80 und Montigel.- NTB 83-12, 1-15.
MUURINEN, A. (1990): Diffusion of uranium in compacted sodium bentonite.- Engineering Geology, 28, 359-367.
PATZKO, A. (1991): Ion exchange and molecular adsorption of a cation active surfactant on montmorillonite.- In: STÖRR, M., HENNING, K.-H., ADOLPHI, P. (Editors): Proc. 7th EUROCLAY Conf. Dresden, p. 827-830.
PUSCH, R., KARNLAND, O. (1990): Preliminary report on longevity of montmorillonite clay under repository-related conditions.- Swedish Nuclear Fuel and Waste Management Co., Stockholm: Report SKB-90-44, ISSN 0284-3757, 47 p.
STOCKMEYER, M. R. (1991): Adsorption of organic compounds on organophilic bentonites.- Appl. Clay Sci., 6, 39-57.